Contoh:
1. Satu mol larutan natrium hidroksida (NaOH) direaksikan dengan 1 mol larutan asam sulfat (H2SO4) sesuai reaksi:
2 NaOH(aq) + H2SO4(aq) –> Na2SO4(aq) + 2 H2O(l)
Tentukan:
a. pereaksi pembatas
b. pereaksi yang tersisa
c. mol Na2SO4 dan mol H2O yang dihasilkan
a. Mol masing-masing zat dibagi koefisien, kemudian pilih hasil bagi yang kecil sebagai pereaksi pembatas
mol NaOH/koefisien NaOH
=1/2 mol
= 0,5 mol
mol H2SO4/koefisien H2SO4
=1/1 mol
= 1 mol
Karena hasil bagi NaOH < H2SO4, maka NaOH adalah pereaksi pembatas, sehingga NaOH akan habis bereaksi lebih dahulu.
b. pereaksi yang sisa adalah H2SO4
c. mol Na2SO4 yang dihasilkan = 0,5 mol
mol H2O yang dihasilkan = 1 mol
2. 100 mL larutan Ca(OH)2 0,1 M direaksikan dengan 100 mL larutan HCl 0,1 M sesuai
reaksi:
Ca(OH)2(aq) + 2 HCl(aq) → CaCl2(aq) + 2 H2O(l)
Tentukan pereaksi pembatas!
Jawab:
mol Ca(OH)2 = M × V = 0,1 mol/liter × 0,1 liter = 0,01 mol
= 0,01 mol / 1 = 0,01 mol
= 0,01 mol / 2 = 0,005 mol
Karena hasil bagi mol mula-mula dengan koefisien pada HCl lebih kecil daripada Ca(OH)2, maka HCl merupakan pereaksi pembatas (habis bereaksi lebih dahulu).
Jadi, pereaksi pembatas adalah larutan HCl. (James E. Brady, 1990)
Konsep perhitungan pereaksi pembatas. Dalam beberapa reaksi kimia, sering
ada yang disebut sebagai pereaksi pembatas (limiting reagent) dan
peraksi berlebih (excess reagent). Terutama jika terdapat perbedaan
jumlah zat yang direaksikan. Maka dari itu, disini akan dibahas bagaimana
perhitungan yang melibatkan pereaksi pembatas.
Konsep Kunci
- Pereaksi (reaktan) pembatas adalah pereaksi yang benar-benar habis digunakan selama reaksi kimia.
- Pereaksi yang berlebih adalah reaktan yang tidak sepenuhnya habis digunakan selama reaksi kimia, dengan kata lain ada beberapa dari reaktan yang tersisa setelah reaksi.
Memilih pereaksi yang digunakan sebagai pembatas dan yang berlebih.
- Tuliskan persamaan reaksi setara untuk reaksi kimia
- Hitung mol yang tersedia dari tiap reaktan dalam reaksi kimia
- Gunakan persamaan reaksi setara untuk menentukan rasio mol dari reaktan dalam reaksi kimia
- Bandingkan mol yang tersedia dari tiap reaktan ke mol yang diperlukan untuk reaksi lengkap dengan menggunakan rasio mol
- Reagen pembatas adalah reaktan yang akan benar-benar habis digunakan. Akan ada beberapa mol reaktan yang tersisa setelah reaksi selesa, yang disebut pereaksi berlebih.
CONTOH
Jika diketahui mol reaktan
Cari pereaksi pembatas dan pereaksi berlebih ketika 0,5 mol Zn bereaksi
dengan 0,4 mol HCl
a.
Tuliskan persamaan reaksi setara untuk reaksi kimia
Zn + 2HCl -----> ZnCl2 + H2
b.
Hitung mol yang tersedia dari tiap reaktan dalam
reaksi kimia
mol Zn = 0,5
|
mol HCl = 0,4
|
c.
Gunakan persamaan reaksi setara untuk menentukan rasio
mol reaktan dalam reaksi kimia
Zn: HCl
|
Atau
|
HCl: Zn
|
1: 2
|
1: ½
|
d.
Bandingkan mol yang tersedia dari tiap pereaksi ke mol
yang diperlukan untuk reaksi lengkap dengan menggunakan rasio mol. Jika
digunakan 0,5 mol Zn, reaksi itu akan membutuhkan
2 x 0,5 = 1,0 mol HCl untuk reaksi.
Hanya ada 0,4 mol HCl yang tersedia yang kurang dari 1,0 mol dibutuhkan. Jika digunakan 0,4 mol HCl, reaksi itu akan membutuhkan
½ x 0,4 = 0,2 mol Zn.
Ada 0,5 mol Zn yang tersedia, sedangkan yang dibutuhkan 0,2 mol.
2 x 0,5 = 1,0 mol HCl untuk reaksi.
Hanya ada 0,4 mol HCl yang tersedia yang kurang dari 1,0 mol dibutuhkan. Jika digunakan 0,4 mol HCl, reaksi itu akan membutuhkan
½ x 0,4 = 0,2 mol Zn.
Ada 0,5 mol Zn yang tersedia, sedangkan yang dibutuhkan 0,2 mol.
e.
Reagen pembatas adalah reaktan yang akan benar-benar
habis digunakan selama reaksi kimia.
Akan ada beberapa mol reaktan yang melebihi tersisa setelah reaksi selesai. Pereaksi pembatas adalah HCl. 0,4 mol HCl akan digunakan ketika reaksi ini berlangsung sampai selesai. Pereaksi berlebih adalah Zn,
ketika reaksi selesai akan masih ada 0,5-0,2 = 0,3 mol Zn .
Akan ada beberapa mol reaktan yang melebihi tersisa setelah reaksi selesai. Pereaksi pembatas adalah HCl. 0,4 mol HCl akan digunakan ketika reaksi ini berlangsung sampai selesai. Pereaksi berlebih adalah Zn,
ketika reaksi selesai akan masih ada 0,5-0,2 = 0,3 mol Zn .
Perhitungan Kimia
A. Penentuan Volume Gas Pereaksi dan Hasil ReaksiPertanyaan yang timbul setelah Gay Lussac mengemukakan hukum
perbandingan volume dapat dipecahkan oleh seorang ahli fisika Italia yang
bernama Amadeo Avogadro pada tahun 1811.
Menurut Avogadro:
”Gas-gas yang volumenya sama, jika diukur pada suhu dan tekanan yang
sama, akan memiliki jumlah molekul yang sama pula”.
Gambar
Ilustrasi percobaan Avogadro, pembentukan dua molekul uap air dari reaksi antara dua
molekul gas hidrogen dan satu molekul gas oksigen
Oleh karena perbandingan volume gas hidrogen, gas oksigen, dan uap air
pada reaksi pembentukan uap air = 2 : 1 : 2 maka perbandingan jumlah molekul
hidrogen, oksigen, dan uap air juga 2 : 1 : 2. Jumlah atom tiap unsur tidak
berkurang atau bertambah dalam reaksi kimia. Oleh karena itu, molekul gas
hidrogen dan molekul gas oksigen harus merupakan molekul dwiatom,
sedangkan molekul uap air harus merupakan molekul triatom.
Perbandingan volume gas dalam suatu reaksi sesuai dengan koefisien reaksi
gas-gas tersebut. Hal ini berarti bahwa, jika volume salah satu gas diketahui,
volume gas yang lain dapat ditentukan dengan cara membandingkan koefisien
reaksinya.
Contoh:
Pada reaksi pembentukan uap air.
2H2(g) + O2(g) –> 2H2O(g)
Jika volume gas H2 yang diukur pada suhu 25°C dan tekanan 1 atm sebanyak 10 L volume gas O2 dan H2O pada tekanan dan suhu yang sama dapat ditentukan dengan cara sebagai berikut.
Volume H2 : Volume O2 = Koefisien H2 : Koefisien O2
B. Massa Atom Relatif dan Massa Molekul Relatif
Setelah ditemukan peralatan yang sangat peka di awal abad XX, para ahli kimia melakukan percobaan tentang massa satu atom. Sebagai contoh, dilakukan percobaan untuk mengukur.
1. massa satu atom H = 1,66 –> 10–24 g
2. massa satu atom O = 2,70 –> 10–23 g
3. massa satu atom C = 1,99 –> 10–23 g
Dari data di atas dapat dilihat bahwa massa satu atom sangat kecil. Para ahli sepakat menggunakan besaran Satuan Massa Atom (sma) atau Atomic Massa Unit (amu) atau biasa disebut juga satuan Dalton. Pada materi struktur atom,
Anda telah mempelajari juga bahwa atom sangatlah kecil, oleh karena itu tidak mungkin menimbang atom dengan menggunakan neraca.
1. Massa Atom Relatif (Ar)
Para ahli menggunakan isotop karbon C–12 sebagai standar dengan massa atom relatif sebesar 12. Massa atom relatif menyatakan perbandingan massa rata-rata satu atom suatu unsur terhadap 1/12 massa atom C–12. Atau dapat dituliskan:
1 satuan massa atom (amu) = 1/12 massa 1 atom C–12
Contoh:
Massa atom rata-rata oksigen 1,33 kali lebih besar dari pada massa atom karbon –12.
Maka: Ar O = 1,33 –> Ar C–12
= 1,33 –> 12
= 15,96
Para ahli membandingkan massa atom yang berbeda-beda, menggunakan skala massa atom relatif dengan lambang ”Ar”.
Para ahli memutuskan untuk menggunakan C–12 atau isotop 12C karena mempunyai kestabilan inti yang inert dibanding atom lainnya. Isotop atom C–12 mempunyai massa atom 12 sma. Satu sma sama dengan 1,6605655 x
10–24 g. Dengan digunakannya isotop 12C sebagai standar maka dapat ditentukan massa atom unsur yang lain.
Massa atom relatif suatu unsur (Ar) adalah bilangan yang menyatakan
perbandingan massa satu atom unsur tersebut dengan 1/12 massa satu atom C–12.
ArX = ( massa atom rata – rata X ) / ( 1/2 massa atom karbon – 12 )
Tabel Massa Beberapa Isotop
Contoh Soal
Jika diketahui massa 1 atom oksigen 2,70 x 10–23 g, berapakah Ar atom O jika
massa atom C 1,99 x 10–23 g?
Jawab:
Besarnya harga Ar juga ditentukan oleh harga rata-rata isotop tersebut. Sebagai contoh, di alam terdapat 35Cl dan 37Cl dengan perbandingan 75% dan 25% maka Ar Cl dapat dihitung dengan cara:
Ar Cl = (75% x 35) + (25% x 37) = 35,5
Ar merupakan angka perbandingan sehingga tidak memiliki satuan. Ar dapat dilihat pada Tabel Periodik Unsur (TPU) dan selalu dicantumkan dalam satuan soal apabila diperlukan
2. Massa Molekul Relatif (Mr)
Molekul merupakan gabungan dari beberapa unsur dengan perbandingan tertentu. Unsur-unsur yang sama bergabung membentuk molekul unsur, sedangkan unsur-unsur yang berbeda membentuk molekul senyawa. Massa molekul unsur atau senyawa dinyatakan oleh massa molekul (Mr). Massa molekul relatif adalah perbandingan massa molekul unsur atau
senyawa terhadap 1/12 x massa atom C–12. Secara matematis dapat dinyatakan:
Contoh Soal :
C. Konsep Mol dan Tetapan Avogadro
Apabila Anda mereaksikan satu atom karbon (C) dengan satu molekul oksigen (O2) maka akan terbentuk satu molekul CO2. Tetapi sebenarnya yang Anda reaksikan bukan satu atom karbon dengan satu molekul oksigen, melainkan sejumlah besar atom karbon dan sejumlah besar molekul oksigen. Oleh karena jumlah atom atau jumlah molekul yang bereaksi begitu besarnya maka untuk menyatakannya, para ahli kimia menggunakan ”mol” sebagai satuan jumlah partikel (molekul, atom, atau ion).
Satu mol didefinisikan sebagai jumlah zat yang mengandung partikel zat itu sebanyak atom yang terdapat dalam 12,000 g atom karbon –12.
Jadi, dalam satu mol suatu zat terdapat 6,022 x 1023 partikel. Nilai 6,022 x 1023 partikel per mol disebut sebagai tetapan Avogadro, dengan lambang L atau N. Dalam kehidupan sehari-hari, mol dapat dianalogikan sebagai ”lusin”. Jika lusin
menyatakan jumlah 12 buah, mol menyatakan jumlah 6,022 x 10 23 partikel zat. Kata partikel pada NaCl, H2O, dan N2 dapat dinyatakan dengan ion dan molekul, sedangkan pada unsur seperti Zn, C, dan Al dapat dinyatakan dengan atom.
Perhatikan tabel berikut!
Tabel Jumlah Partikel dalam Beberapa Zat
Rumus kimia suatu senyawa menunjukkan perbandingan jumlah atom yang ada dalam senyawa tersebut.
Tabel Perbandingan Atom-Atom dalam H2SO4
Contoh Soal
1. Massa Molar (Mr)
Massa satu mol zat dinamakan massa molar (lambang Mr). Besarnya massa molar zat adalah massa atom relatif atau massa molekul relatif zat yang dinyatakan dalam satuan gram per mol.
Massa molar = Mr atau Ar zat (g/mol)
Perhatikan contoh pada tabel berikut!
Tabel Massa Molar Beberapa Zat
Massa suatu zat merupakan perkalian massa molarnya (g/mol) dengan mol zat tersebut (n). Jadi hubungan mol suatu zat dengan massanya dapat dinyatakan sebagai berikut.
Secara matematis, dapat dinyatakan sebagai berikut.
Massa molar = massa : mol
Massa = mol x Mr/Ar (massa molar)
Contoh Soal
2. Volume Molar (Vm)
Volume satu mol zat dalam wujud gas dinamakan volume molar, yang dilambangkan dengan Vm.
Berapakah volume molar gas? Bagaimana menghitung volume sejumlah tertentu gas pada suhu dan tekanan tertentu?
Avogadro dalam percobaannya mendapat kesimpulan bahwa 1 L gas oksigen pada suhu 0° C dan tekanan 1 atm mempunyai massa 1,4286 g, atau dapat dinyatakan bahwa pada tekanan 1 atm:
Maka, berdasarkan hukum Avogadro dapat disimpulkan:
1 mol gas O2 = 22,4 L
Sesuai dengan hukum Avogadro yang menyatakan bahwa pada suhu dan tekanan yang sama, volume gas yang sama mengandung jumlah molekul yang sama atau banyaknya mol dari tiap-tiap gas volumenya sama. Berdasarkan hukum tersebut berlaku volume 1 mol setiap gas dalam keadaan standar (suhu 0° C dan tekanan 1 atm) sebagai berikut.
Volome gas dalam keadaan standar = 22,4 L
Contoh soal
Berapa volume gas CO2 yang massanya 22 g (Ar : C = 12, O = 16) jika diukur pada
tekanan 1 atm?
Jawab:
Mr CO2 = 44Berapa volume gas CO2 yang massanya 22 g (Ar : C = 12, O = 16) jika diukur pada
tekanan 1 atm?
Jawab:
Mr CO2 = 44
3. Volume Gas pada Keadaan Tidak Standar
Perhitungan volume gas tidak dalam keadaan standar (non-STP) digunakan dua pendekatan sebagai berikut.
a. Persamaan gas ideal
Dengan mengandaikan gas yang akan diukur bersifat ideal, persamaan yang menghubungkan jumlah mol (n) gas, tekanan, suhu, dan volume
yaitu:
Hukum gas ideal : P . V = n . R . T
Di mana:
P = tekanan (satuan atmosfir, atm)
V = volume (satuan liter, L)
n = jumlah mol gas (satuan mol)
R = tetapan gas (0,08205 L atm/mol K)
T = suhu mutlak (°C + 273,15 K)
Contoh Soal
Tentukan volume dari 4,4 g gas CO2 yang diukur pada tekanan 2 atm dan suhu
27° C! (Ar : C = 12, O = 16)
b. Dengan konversi gas pada suhu dan tekanan yang sama
Menurut hukum Avogadro, perbandingan gas-gas yang jumlah molnya sama memiliki volume sama. Secara matematis dapat dinyatakan sebagai berikut.
V1/V2 =n1/n2
Di mana:
n1 = mol gas 1 V1 = volume gas 1
n2 = mol gas 2 V2 = volume gas 2
Contoh Soal
Berapa volume 4 g gas metana (CH4) yang diukur pada keadaan sama dengan
3 g NO volumenya 5 L (Ar : H = 1, C = 12, N = 14, O = 16)?
Jawab:
Mr CH4 = 16
4. Molaritas (M)
Banyaknya zat yang terdapat dalam suatu larutan dapat diketahui dengan menggunakan konsentrasi larutan yang dinyatakan dalam molaritas (M). Molaritas menyatakan banyaknya mol zat dalam 1 L larutan. Secara matematis dinyatakan sebagai berikut.
Di mana:
M = molaritas (satuan M)
massa = dalam satuan g
Mr = massa molar (satuan g/mol)
V = volume (satuan mL)
Contoh Soal
Tentukan molaritas jika 4 g NaOH dilarutkan dalam:
a. 2 L air
b. 500 mL air
Jawab:
Hubungan mol dengan massa, jumlah partikel dan volume pada STP, dapat digambarkan sebagai berikut.
D. Rumus Molekul dan Kadar Unsur dalam Senyawa
Perbandingan massa dan kadar unsur dalam suatu senyawa dapat ditentukan dari rumus molekulnya.
Di mana,
contoh soal
Berapakah kadar C dan N dalam urea (CO(NH2)2)?
(Ar : C = 12 ; N = 4 ; O = 16 ; dan H = 1)
Jawab:
1 mol urea mengandung 1 atom C, 1 atom O, 2 atom N dan 4 atom H.
Mr urea = 12 + 16 + 28 + 4 = 60
1. Penentuan Rumus Empiris dan Rumus Molekul
Rumus kimia menunjukkan jenis atom unsur dan jumlah relatif masingmasing unsur yang terdapat dalam zat. Banyaknya unsur yang terdapat dalam zat ditunjukkan dengan angka indeks.
Rumus kimia dapat berupa rumus empiris dan rumus molekul.
”Rumus empiris, rumus yang menyatakan perbandingan terkecil atomatom
dari unsur-unsur yang menyusun senyawa”.
”Rumus molekul, rumus yamg menyatakan jumlah atom-atom dari
unsur-unsur yang menyusun satu molekul senyawa”.
Perhatikan contoh rumus molekul dan rumus empiris beberapa senyawa
dalam tabel berikut.
Tabel Rumus Molekul dan Rumus Empiris Beberapa Senyawa
Rumus Molekul = ( Rumus Empiris )n
Mr Rumus Molekul = n x (Mr Rumus Empiris
n = bilangan bulat
Penentuan rumus empiris dan rumus molekul suatu senyawa dapat ditempuh dengan langkah berikut.
1. Cari massa (persentase) tiap unsur penyusun senyawa,
2. Ubah ke satuan mol,
3. Perbandingan mol tiap unsur merupakan rumus empiris,
4. Cari rumus molekul dengan cara: (Mr rumus empiris)n = Mr rumus molekul, n dapat dihitung,
5. Kalikan n yang diperoleh dari hitungan dengan rumus empiris.
Contoh soal
1. Suatu senyawa terdiri dari 43,7% P dan 56,3% O. Tentukan rumus molekul!
(Ar : P = 31 dan O = 16)
Jawab:
Misal massa senyawa = 100 g
Maka massa P dan O masing-masing 43,7 g dan 56,3 g.
Jadi, rumus molekul P2O5.
2. Suatu senyawa terdiri dari 60% karbon, 5% hidrogen, dan sisanya nitrogen. Mr senyawa itu = 80 (Ar : C = 12 ; H = 1 ; N = 14). Tentukan rumus empiris dan rumus molekul senyawa itu!
Jawab:
Persentase nitrogen = 100% – ( 60% + 5% ) = 35%.
Misal massa senyawa = 100 g
Maka massa C : H : N = 60 : 5 : 35
Perbandingan mol C : mol H : mol N = 5 : 5 : 2,5 = 2 : 2 :1
Maka rumus empiris = (C2H2N)n. (Mr rumus empiris)n = Mr rumus molekul
(C2H2N)n = 80
(24 + 2 + 14)n = 80
40n = 80
n = 2
Jadi, rumus molekul senyawa tersebut = (C2H2N)2 = C4H4N2.
2. Menentukan Rumus Kimia Hidrat (Air Kristal)
Hidrat adalah senyawa kristal padat yang mengandung air kristal (H2O). Rumus kimia senyawa kristal padat sudah diketahui. Jadi pada dasarnya penentuan rumus hidrat merupakan penentuan jumlah molekul air kristal (H2O) atau nilai x. Secara umum, rumus hidrat dapat ditulis sebagai berikut.
Rumus kimia senyawa kristal padat: x . H2O
Sebagai contoh garam kalsium sulfat, memiliki rumus kimia CaSO4 . 2H2O, artinya dalam setiap satu mol CaSO4 terdapat 2 mol H2O. Beberapa senyawa berhidrat/berair kristal dapat Anda lihat dalam tabel berikut.
Tabel Beberapa Senyawa Berhidrat
Contoh Soal
1. Sebanyak 5 g tembaga (II) sulfat hidrat dipanaskan sampai semua air kristalnya menguap. Massa tembaga (II) sulfat padat yang terbentuk 3,20 g. Tentukan rumus hidrat tersebut! (Ar : Cu = 63,5 ; S = 32 ; O = 16 ; H = 1)
Jawab:
Langkah-langkah penentuan rumus hidrat:
a. Misalkan rumus hidrat CuSO4 . x H2O.
b. Tulis persamaan reaksinya.
c. Tentukan mol zat sebelum dan sesudah reaksi.
d. Hitung nilai x, dengan menggunakan perbandingan mol CuSO4 : mol
H2O.
CuSO4 . xH2O(s) –> CuSO4(s) + xH2O
5 g 3,2 g 1,8 g
Perbandingan, mol CuSO4 : mol H2O = 0.02 : 0,10.
Perbandingan, mol CuSO4 : mol H2O = 1 : 5.
Jadi, rumus hidrat dari tembaga(II) sulfat yaitu CuSO4 . 5H2O.
3. Hitungan Kimia
Penentuan jumlah pereaksi dan hasil reaksi yang terlibat dalam reaksi harus diperhitungkan dalam satuan mol. Artinya, satuan-satuan yang diketahui harus diubah ke dalam bentuk mol. Metode ini disebut metode pendekatan mol.
Adapun langkah-langkah metode pendekatan mol tersebut dapat Anda simak dalam bagan berikut.
contoh Soal
4. Pereaksi Pembatas
Di dalam suatu reaksi kimia, perbandingan mol zat-zat pereaksi yang dicampurkan tidak selalu sama dengan perbandingan koefisien reaksinya. Hal ini berarti bahwa ada zat pereaksi yang akan habis bereaksi lebih dahulu.
Pereaksi demikian disebut pereaksi pembatas. Bagaimana hal ini dapat terjadi?
Anda perhatikan gambar di bawah ini!
X + 2Y –> XY2
Reaksi di atas memperlihatkan bahwa menurut koefisien reaksi, satu mol zat X membutuhkan dua mol zat Y. Gambar di atas menunjukkan bahwa tiga molekul zat X direaksikan dengan empat molekul zat Y. Setelah reaksi berlangsung, banyaknya molekul zat X yang bereaksi hanya dua molekul dan satu molekul tersisa. Sementara itu, empat molekul zat Y habis bereaksi. Maka zat Y ini disebut pereaksi pembatas. Pereaksi pembatas merupakan reaktan yang habis bereaksi dan tidak bersisa di akhir reaksi.
Dalam hitungan kimia, pereaksi pembatas dapat ditentukan dengan cara membagi semua mol reaktan dengan koefisiennya, lalu pereaksi yang mempunyai nilai hasil bagi terkecil merupakan pereaksi pembatas.
contoh soal
Diketahui reaksi sebagai berikut S(s) + 3F2(g) –> SF6(g).
Jika direaksikan 2 mol S dengan 10 mol F2, tentukan:
a. Berapa mol SF6 yang terbentuk?
b. Zat mana dan berapa mol zat yang tersisa?
Jawab:
S + 3F2 –> SF6
Dari koefisien reaksi menunjukkan bahwa 1 mol S membutuhkan 3 mol F2. Kemungkinan yang terjadi sebagai berikut.
a. Jika semua S bereaksi maka F2 yang dibutuhkan:
Hal ini memungkinkan karena F2 tersedia 10 mol.
b. Jika semua F2 habis bereaksi maka S yang dibutuhkan:
Hal ini tidak mungkin terjadi, karena S yang tersedia hanya 2 mol.
Jadi, yang bertindak sebagai pereaksi pembatas adalah S!
Banyaknya mol SF6 yang terbentuk = x mol S.
a. Mol SF6 = 1 x 2 mol = 2 mol
b. Zat yang tersisa F2, sebanyak = 10 mol – 6 mol = 4 mol F2
Apabila hanya melibatkan dua buah gas maka berlaku rumus-rumus sebagai
berikut.
Di mana:
P = tekanan (satuan atmosfir, atm)
V = volume (satuan liter, L)
n = jumlah mol gas
R = tetapan gas (0,08205 L atm/mol. K)
T = suhu mutlak (°C + 273,15 K )




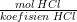



































0 komentar:
Posting Komentar